新聞中心
News Center
聚焦HER2陽性乳腺癌后線治療,中國生物制藥啟動TQB2930關鍵Ⅲ期臨床
發布時間:2025-07-07
近日,中國生物制藥(1177.HK)下屬企業正大天晴登記了TQB2930的首個Ⅲ期臨床試驗,擬用于HER2(人類表皮生長因子受體2)陽性復發/轉移性乳腺癌的治療。2025 ASCO公布的臨床結果顯示,TQB2930有望為歷經多線治療失敗,尤其是對新型HER2抗體偶聯藥物(ADC)產生耐藥或不耐受的患者,提供新的治療選擇。
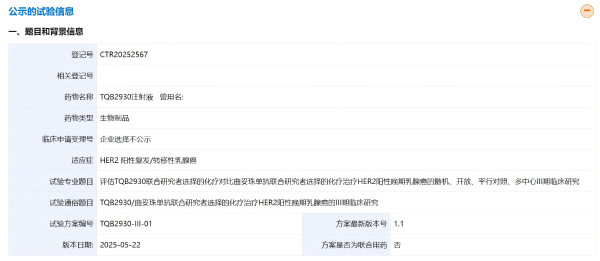
此次登記的是一項隨機、開放、平行對照、多中心Ⅲ期臨床研究,旨在評估TQB2930聯合研究者選擇的化療對比曲妥珠單抗聯合研究者選擇的化療治療 HER2 陽性晚期乳腺癌的有效性和安全性。本研究擬入組416人,主要終點是通過獨立評審委員會(IRC)評估的無進展生存期(PFS);次要終點指標包括通過研究者評估的PFS、研究者及IRC評估的緩解持續時間(DOR)、客觀緩解率(ORR)、疾病控制率(DCR)、臨床獲益率(CBR)、總生存期(OS)等。
TQB2930是正大天晴自主研發的一款靶向HER2的雙特異性抗體,一端靶向HER2的ECD2抗原表位(帕妥珠單抗結合位點),另一端互補結合HER2的ECD4抗原表位(曲妥珠單抗結合位點)。
TQB2930的潛力已在早期臨床研究中得到初步驗證。2025年ASCO大會上公布了TQB2930聯合化療在既往接受過≥2線治療的HER2陽性乳腺癌中的Ⅰb/Ⅱ期研究結果。研究共納入55例至少2線抗HER2藥物治療失敗的HER2陽性乳腺癌患者,在52例可評估療效的患者中ORR為48.1%,其中88.5%(46/52)的患者靶病灶縮小;中位PFS和OS尚未達到,6個月PFS率估計為71%;在既往接受其他 HER2-ADC治療失敗的患者中,ORR為50%[1]。
乳腺癌可分為LuminalA型、LuminalB型、HER2陽性型以及三陰性型4種亞型。其中,HER2陽性乳腺癌以其高復發風險、預后差及侵襲性強等特點顯得尤為棘手,在傳統療法及多線靶向治療失敗后,患者往往陷入無藥可用的困境。TQB2930關鍵Ⅲ期臨床試驗的推進,有望為多線治療失敗的HER2陽性乳腺癌患者,特別是新型HER2 ADC治療失敗/不耐受者帶來新的治療選擇。
參考文獻:
[1] Qingyuan Zhang, et al. Efficacy and safety results of TQB2930, a HER2-targeted bispecific antibody combined with chemotherapy in patients with HER2-positive breast cancer (BC) previously treated with ≥2 line treatments: Results from a phase 1b/2 study.2025 ASCO.
聲明:
1.新聞稿旨在促進醫藥信息的溝通和交流,僅供醫療衛生專業人士參閱,非廣告用途。
2.本公司不對任何藥品和/或適應癥作推薦。
3.本新聞稿中涉及的信息僅供參考,不能以任何方式取代專業的醫療指導,也不應被視為診療建議。若您想了解具體疾病診療信息,請遵從醫生或其他醫療衛生專業人士的意見或指導。
前瞻性聲明:
本新聞稿中包含若干前瞻性陳述,包括有關【TQB2930】的臨床開發計劃、臨床獲益與優勢的預期、商業化展望、患者臨床獲益可能性,以及潛在商業機會等聲明。“預期”、“相信”、“繼續”、“可能”、“估計”、“期望”、“有望”、“打算”、“計劃”、“潛在”、“預測”、“預計”、“應該”、“將”、“擬”、“會”和類似表達旨在識別前瞻性陳述,但并非所有前瞻性陳述都包含這些識別詞。這些前瞻性陳述為公司基于當前所掌握的數據和信息所做的預測或期望,可能因受到政策、研發、市場及監管等不確定因素或風險的影響,而導致實際結果與前瞻性陳述有重大差異。請現有或潛在的投資者審慎考慮可能存在的風險,并不可完全依賴本新聞稿中的前瞻性陳述,該等陳述包含信息僅及于本新聞稿發布當日。除非法律要求,本公司無義務因新信息、未來事件或其他情況而對本新聞稿中任何前瞻性陳述進行更新或修改。