新聞中心
News Center
中位總生存期28.9個月,中國生物制藥又一創新藥研究榮登國際權威期刊
發布時間:2024-10-12
近日,中國生物制藥1類創新藥貝莫蘇拜單抗聯合安羅替尼治療EGFR TKIs耐藥非小細胞肺癌II期臨床研究發表于國際權威期刊《信號轉導與靶向治療(Signal Transduction and Targeted Therapy)》(STTT,IF:40.8)。該研究中,受試者中位(總生存期)OS長達28.9個月,有望為EGFR TKIs耐藥人群帶來新的治療選擇。

針對EGFR突變,探索去化療新方案
在亞洲晚期非小細胞肺癌(NSCLC)患者中,表皮生長因子受體(EGFR)突變率高達51.4%[1]。含鉑雙藥化療±貝伐珠單抗方案已成為EGFR TKIs耐藥的EGFR突變陽性晚期NSCLC患者的標準治療。但由于化療毒性較大、治療依從性欠佳,對于EGFR TKIs耐藥后的NSCLC患者,仍需要更安全、方便且療效相當的去化療方案[2]。
在2019年世界肺癌大會上發表的一項信迪利單抗聯合安羅替尼去化療一線治療NSCLC研究表明,免疫藥物聯合抗血管生成藥物在EGFR陰性晚期NSCLC患者中顯示了一定的抗腫瘤潛力(客觀緩解率:77.3%;6個月無進展生存率:93.8%)。
基于上述,江蘇省腫瘤醫院史美祺教授設計了此項去化療I/II期研究,以評估貝莫蘇拜單抗(PD-L1抗體)聯合安羅替尼在EGFR TKIs耐藥后的EGFR陽性晚期NSCLC患者中的療效和安全性。
中位總生存期28.9個月,成績亮眼
本研究是一項多中心、單臂、開放標簽的I/II期研究(ChiCTR1900026273)[3]。在I期研究中,9例患者接受了安羅替尼(3個劑量水平)+貝莫蘇拜單抗治療,觀察治療一個周期內的劑量限制毒性(DLT),以確定患者的最大耐受劑量(MDT)。2020年8月至2022年10月,55例患者被納入II期劑量擴展隊列。
在II期研究中,55例患者接受安羅替尼+貝莫蘇拜單抗治療,連續用藥直至出現符合終止標準的事件。至本次研究結果報告時(中位隨訪時間22.8個月),中位無進展生存期(PFS)為9.0個月,中位總生存期(OS)為28.9個月,12個月、18個月的OS率分別為86.7%和66.9%。
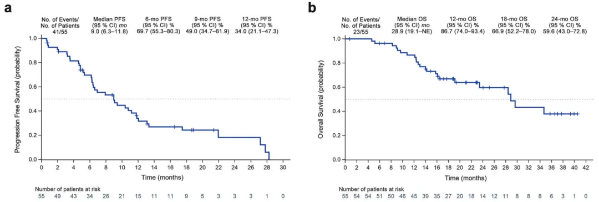
PFS和OS曲線圖
在II期全分析人群中,次要終點客觀緩解率(ORR)為25.5%,疾病控制率(DCR)為87.3%。
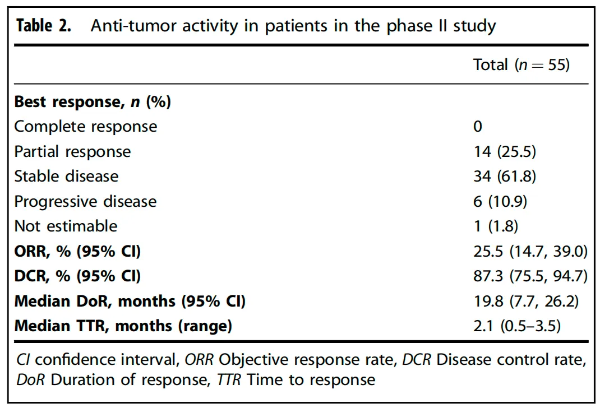
腫瘤緩解情況
研究表明,貝莫蘇拜單抗聯合安羅替尼這一去化療的組合有望成為EGFR TKIs耐藥的晚期NSCLC患者的治療新選擇。安羅替尼作為中國生物制藥腫瘤領域明星產品,2018年上市以來已在國內獲批六大適應癥,榮獲“中國新藥開拓獎”。貝莫蘇拜單抗是中國生物制藥自主研發的新型PD-L1抑制劑,2024年5月獲批上市用于廣泛期小細胞肺癌一線治療,可開發的潛在適應癥空間大。
未來,中國生物制藥將加速拓展安羅替尼和貝莫蘇拜單抗適應癥,提高腫瘤患者用藥的可及性。中國生物制藥將腫瘤治療作為重點研發領域之一,將繼續秉承“專注創新,服務病患,成為全球領先的制藥企業”的發展愿景,依托強大的研發實力和豐富的產品線,不斷探索腫瘤治療的新領域、新方法。
參考文獻:
1. Goss GD, Spaans JN. Epidermal growth factor receptor inhibition in the management of squamous cell carcinoma of the lung [J]. Oncologist, 2016, 21(2): 205-213.
2. HE J, HUANG Z, HAN L, et al. Mechanisms and management of 3rd?generation EGFR?TKI resistance in advanced non?small cell lung cancer (Review) [J]. Int J Oncol, 2021, 59 (5): 90.
3. Meiqi Shi, et al. Benmelstobart plus anlotinib in patients with EGFR-positive advanced NSCLC after failure of EGFR TKIs therapy: a phase I/II study.Signal Transduction and Targeted Therapy (2024) 9:283.
▲ 上下滑動查看更多
聲明:
1.本新聞稿旨在促進醫藥信息的溝通和交流,僅供醫療衛生專業人士參閱,非廣告用途。
2.本公司不對任何藥品和/或適應癥作推薦。
3. 本新聞稿中涉及的信息僅供參考,不能以任何方式取代專業的醫療指導,也不應被視為診療建議。若您想了解具體疾病診療信息,請遵從醫生或其他醫療衛生專業人士的意見或指導。
前瞻性聲明:
本新聞稿中包含若干前瞻性陳述,包括有關【鹽酸安羅替尼膠囊、貝莫蘇拜單抗注射液】的臨床開發計劃、臨床獲益與優勢的預期、商業化展望、患者臨床獲益可能性,以及潛在商業機會等聲明。“預期”、“相信”、“繼續”、“可能”、“估計”、“期望”、“有望”、“打算”、“計劃”、“潛在”、“預測”、“預計”、“應該”、“將”、“擬”、“會”和類似表達旨在識別前瞻性陳述,但并非所有前瞻性陳述都包含這些識別詞。這些前瞻性陳述為公司基于當前所掌握的數據和信息所做的預測或期望,可能因受到政策、研發、市場及監管等不確定因素或風險的影響,而導致實際結果與前瞻性陳述有重大差異。請現有或潛在的投資者審慎考慮可能存在的風險,并不可完全依賴本新聞稿中的前瞻性陳述,該等陳述包含信息僅及于本新聞稿發布當日。除非法律要求,本公司無義務因新信息、未來事件或其他情況而對本新聞稿中任何前瞻性陳述進行更新或修改。
內容來源:中國生物制藥有限公司官網、正大天晴“晴醫薈”公眾號